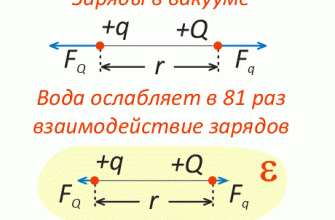
Устройство и принцип работы аккумуляторной батареи
Как известно, работа современных портативных устройств основана на использовании автономного источника питания, роль которого выполняет аккумуляторная батарея (АКБ). Также такой источник энергии является обязательным узлом автомобильного транспорта, который помогает запустить машину при помощи стартера. Принцип работы аккумуляторной батареи достаточно прост. Если соблюдать правила использования, то аккумулятор будет работать без перегруза и не уменьшать свою емкость в процессе использования.
АКБ служит для электрического питания цепей управления и бортовой сети, когда двигатель не работает. Но самое главное его предназначение – пуск двигателя. АКБ приводит в действие стартер, во время заводки двигателя автомобиля.
Аккумулятор 12В состоит из нескольких независимых друг от друга банок — аккумуляторов по 2 В. каждый. Аккумуляторы последовательно собираются и соединяются между собой в одном корпусе.
В состав активного вещества входит свинцовый порошок с добавлением серной кислоты. В отрицательных пластинах размещается сернокислый барий. Во время формировки АКБ пластины заряжаются, и активное вещество превращается в диоксид свинца, а в отрицательных – в губчатый свинец.
Электролит – специальная жидкость, которая заливается в банки аккумулятора и служит для движения заряженных частиц от полюса к полюсу. Электролит состоит из серной кислоты и очищенной дистиллированной воды.
Между пластинами электродов, для предотвращения замыкания, вставлены сепараторы – пористые пластины, которые не препятствуют циркуляции электролита и не взаимодействуют с ним.
Принцип действия аккумуляторов
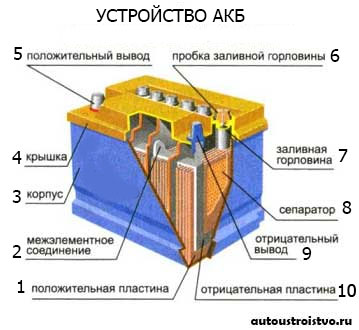
 Принцип действия аккумулятора основан на образовании разности потенциалов между двумя электродами, погруженными электролит. При подключении нагрузки (электротехнических устройств) к клеммам аккумулятора в реакцию вступают электролит и активные элементы электродов. Происходит процесс перемещения электронов, который, по сути, и является электротоком.
Принцип действия аккумулятора основан на образовании разности потенциалов между двумя электродами, погруженными электролит. При подключении нагрузки (электротехнических устройств) к клеммам аккумулятора в реакцию вступают электролит и активные элементы электродов. Происходит процесс перемещения электронов, который, по сути, и является электротоком.
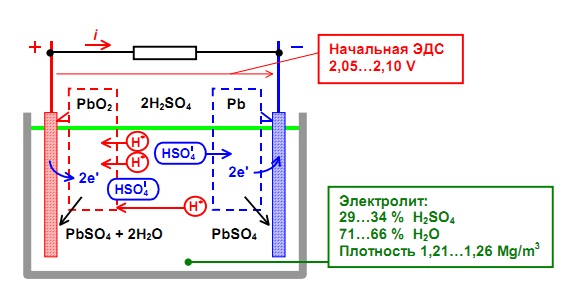
При разряде аккумулятора (подключении нагрузки) губчатый свинец анода выделяет положительные двухвалентные ионы свинца в электролит. Избыточные электроны перемещаются по внешней замкнутой электрической цепи к катоду, где происходит восстановление четырехвалентных ионов свинца до двухвалентных.
При их соединении с отрицательными ионами серного остатка электролита, образуется сульфат свинца на обоих электродах.
Ионы кислорода от диоксида свинца катода и ионы водорода из электролита соединяются, образуя молекулы воды. Поэтому плотность электролита понижается. 
При заряде происходят обратные реакции. Под воздействием внешнего напряжения ионы двухвалентного свинца положительного электрода отдают по два электрона и окисляются в четырехвалентные. Эти электроны движутся к аноду и нейтрализуют ионы двухвалентного свинца, восстанавливая губчатый свинец. На катоде, путем промежуточных реакций, снова образуется двуокись свинца.
Химические реакции в одной ячейке вырабатывают напряжение 2 В, поэтому на клеммах аккумулятора из 6 ячеек и получается 12 В.
Из видео Вы сможете более подробно узнать, как работает аккумулятор:
Одноименные пластины соединены между собой свинцовыми перемычками, как и разделенные перегородками пакеты пластин, составляющие отдельные элементы, и выводы аккумулятора — тоже изготовлены из свинца.
Электрическим аккумулятором называют химический источник тока многоразового действия. Химические процессы внутри аккумулятора, в отличие от оных в одноразовых гальванических элементах, таких как щелочные или солевые батарейки, обратимы. Циклы заряда-разряда, накопления и отдачи электрической энергии, могут многократно повторяться.
Так, сам принцип действия аккумулятора позволяет циклически использовать его для автономного электроснабжения разнообразных устройств, портативных приборов, транспортных средств, медицинского оборудования и т. д. в совершенно различных сферах.

Произнося слово «аккумулятор», имеют ввиду или сам аккумулятор или аккумуляторную ячейку. Несколько последовательно или параллельно соединенных друг с другом аккумуляторных ячеек образуют аккумуляторную батарею, как и несколько соединенных аккумуляторов.
Первый аккумулятор, то есть гальванический элемент многоразового использования, появился, по официальным данным, в 1803 году. Его создал немецкий физик и химик Иоганн Вильгельм Риттер. Друг Эрстеда, Риттер, не будучи ученым, изучал химическое действие света, проводил эксперименты с электролизом, ему, кстати, принадлежит открытие ультрафиолетовой части электромагнитного спектра.
Однажды экспериментируя с вольтовым столбом, Риттер взял пятьдесят кружков из меди, куски влажного сукна, и составил столб из пятидесяти таких кружков и влажного сукна между ними. Пропустив через конструкцию ток от вольтова столба, Риттер обнаружил, что его столб зарядился и сам стал источником электричества. Это и был первый аккумулятор.
Обратимость химической реакции в электролите и на электродах аккумулятора позволяет восстанавливать работоспособность аккумулятора — заряжать его после разряда. Ток в процессе заряда пропускается через аккумулятор в направлении, противоположном разряду.
Так например, свинцово-кислотный аккумулятор работает благодаря электрохимическим реакциям свинца и диоксида свинца в серной кислоте. Формулы ниже отражают обратимые реакции, протекающие на аноде и на катоде: слева направо — реакция при разряде, справа налево — заряд.
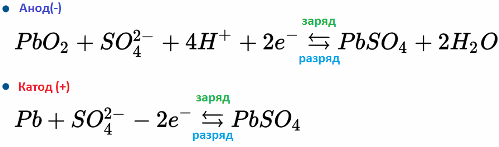
Рассмотрим теперь устройство аккумулятора на примере автомобильной стартерной батареи. Ее напряжение 12 вольт. Состоит батарея из шести соединенных последовательно гальванических элементов, разделенных перегородками.
Последовательное соединение в данном случае обозначает, что отрицательный вывод одной ячейки подключен к положительному выводу следующей ячейки.
Каждый элемент включает в себя пару решетчатых электродов из свинцово-сурьмянистого сплава, погруженных в электролит, представляющий собой 38% водный раствор серной кислоты. Пористый сепаратор изолирует электроды друг от друга, предотвращая замыкания между ними, но свободно пропускает через себя электролит. То есть жидкость заполняет как ячейки свинцовых пластин, так и поры сепараторов.
Одноименные пластины соединены между собой свинцовыми перемычками, как и разделенные перегородками пакеты пластин, составляющие отдельные элементы, и выводы аккумулятора — тоже изготовлены из свинца.
Выводы автомобильного аккумулятора всегда немного отличаются в размере друг от друга — плюсовая клемма больше в диаметре чем минусовая, чтобы не ошибиться при подключении.
Корпус аккумулятора изготавливается из диэлектрического материала устойчивого к агрессивным средам, к перепадам температур и к вибрациям. Сегодня корпусы стартерных АКБ делают из полипропилена.
Корпус представляет собой герметично закрытую емкость с крышкой, оснащенную отбортовками для прочного крепления. В корпусах старых аккумуляторов всегда предусматривались пробки над каждым из гальванических элементов, составляющих батарею, чтобы можно было при необходимости доливать в них дистиллированную воду. Современные необслуживаемые аккумуляторы пробок на корпусах не имеют.
Другие статьи про аккумумляторы и их использование:
Аккумулятор – специальн о разработанное устройство, где выработка энергии происходит благодаря химическим процессам. Энергия, выделяемая при химических реакциях, преобразовывается в электрическую, далее отдает заряд для различных приборов, устройств. Процесс этот обратимый. При разряде батареи электрическая энергия переходит в химическую, накапливая при этом энергетический запас.
Аккумуляторы в действии: как работает аккумуляторная батарея?
Аккумуляторные батареи, как и любая другая техника, имеют свое оригинальное устройство, структуру. В современных аккумуляторах используются определенные материалы, внедряются системы, основанные на физических и химических свойствах конкретных веществ и металлов. Рассмотрим принцип работы аккумуляторной батареи на примере свинцово-кислотных.
Первое, с чем мы сталкиваемся – корпус. Корпус батареи должен быть надежным, качественным. Ведь внутри, забегая наперед, — сложные химические вещества. Ненадежный, хлипкий, некачественный корпус был бы попросту небезопасным для использования. Корпусная коробка, где помещены все основные элементы, обязательно должн а быть стойкой к вибрациям, полностью герметизированной, на нее не должны оказывать химическое воздействие различные вещества, реагенты.
Под крышкой корпуса расположены два электрода – специальные пластины разных зарядов, положительного и отрицательного (в физической терминологии они называются анодом и катодом соответственно). Они зачастую изготавливаются из свинца, а сама конструкция таких пластин – решетчатая. Конструкция нужна для того, чтобы
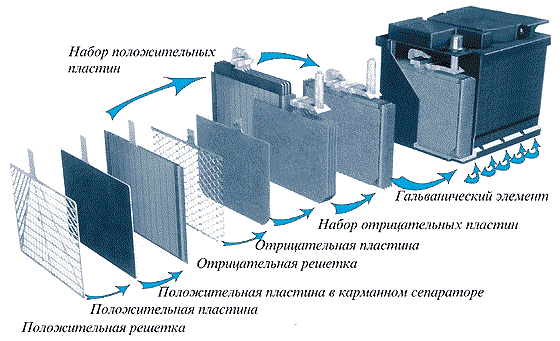
химические реакции протекали более надежно и работоспособно.
Положительную пластину дополнительно намазывают так называемой активной массой – комбинация свинца и кислорода, в результате чего получается двуокись свинца (PbO2). Отрицательная электродная решетка покрывается активной массой из обычного губчатого свинца. В таблице Менделеева элемент обозначен как Pb.
Между электродными пластинами обязательно помещают дополнительный изоляционный материал. Делается это для того, чтобы при использовании батареи избежать короткого замыкания.
Последний элемент нашей батареи – электролит, который представляет собой жидкость серной кислоты. В жидкость помещаются электродные решетчатые блоки.
Принцип работы аккумулятора не сложен, однако нужно понять все, что происходит внутри:
- когда к аккумулятору подключается нагрузка (какой-нибудь электронный прибор, механизм и проч.), внутри батареи образуется замкнутая цепь из комбинации электродных пластин, электролита и непосредственно нагрузки;
- внутри аккумуляторной батареи начинается происходить ожидаемая нами реакция: активный массы двух пластин (Pb и PbO2) начинаются преобразовываться в совсем другое вещество – сернокислотный свинец (формула его выглядит так – PbSO4);
- плотность электролитного вещества (серной кислоты) начинает постепенно снижаться;
- в замкнутой цепи начинают двигаться ионы, после чего начинает течь электрический ток.
Описанный выше процесс называется разрядом – когда аккумулятор в результате внутренних химических преобразований отдает электрический ток. Обратный процесс – заряд, когда к батарее подключают внешний источник тока. При обратном процессе все вещества восстанавливаются, электролитная масса (серная кислота) начинает обретать свою первоначальную плотность.
При постоянном напряжении источника зарядного тока по мере увеличения степени заряженности аккумулятора повышается его ЭДС и, следовательно, уменьшается сила зарядного тока. Когда напряжение на клеммах источника тока будет равно ЭДС полностью заряженного аккумулятора плюс ЭДС поляризации, зарядный ток прекратится.
Принцип работы свинцового аккумулятора
Свинцовый аккумулятор электрической энергии был изобретен в 1859 году французским физиком Гастоном Планте. В последующие годы конструкция аккумулятора, особенно – химический состав его электродов (пластин) постоянно совершенствовалась. В настоящее время свинцовые аккумуляторы и аккумуляторные батареи широко применяются в разных областях техники в качестве накопителей электроэнергии (стартерные батареи, аварийные и резервные источники энергии и т. п.).
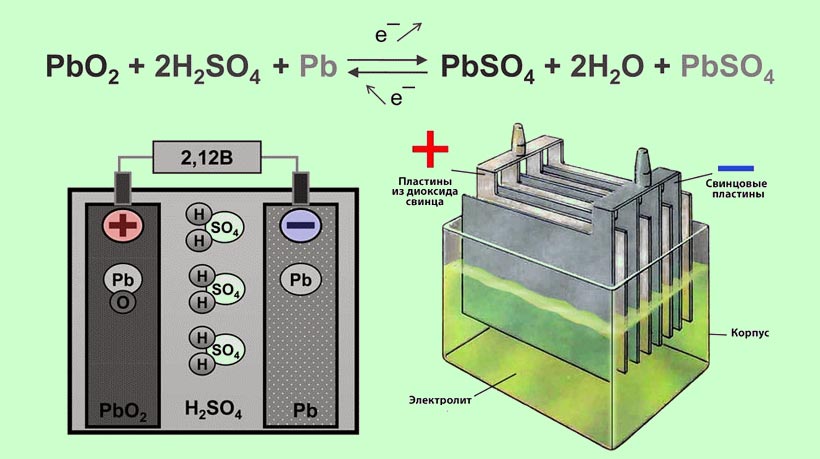
Конструктивно аккумулятор представляет собой емкость, наполненную электролитом, в которой размещены свинцовые электроды. В качестве электролита используется раствор серной кислоты и дистиллированной воды. Электроды выполнены в виде пластин, одна из которых изготовлена из губчатого свинца Pb, а вторая – из диоксида свинца PbO2. При взаимодействии электродов с электролитом между ними возникает разность потенциалов.
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в водном растворе серной кислоты.
При подключении к электродам аккумулятора внешней нагрузки начинается электрохимическая реакция взаимодействия оксида свинца и серной кислоты, при этом металлический свинец окисляется до сульфата свинца.
Во время разряда происходит восстановление диоксида свинца на положительном электроде (аноде) и окисление свинца на отрицательном электроде (катоде). При пропускании через электроды аккумулятора зарядного тока в нем протекают обратные реакции. При перезаряде аккумулятора, после исчерпания сульфата свинца начинается электролиз воды, при этом на аноде выделяется кислород, а на катоде — водород.
Электрохимические реакции (слева направо — при разряде, справа налево — при заряде):
Реакции на аноде:
Реакции на катоде:
Физические процессы, происходящие в аккумуляторе, объясняются свойством электролитического растворения металлов, которое заключается в переходе положительно заряженных ионов металла в раствор. Легкоокисляющиеся металлы (например, свинец) обладают этим свойством в большей степени, чем инертные металлы.
При погружении свинцового электрода в раствор электролита от него начнут отделяться положительно заряженные ионы свинца и переходить в раствор, при этом сам электрод будет заряжаться отрицательно.
По мере протекания процесса растет разность потенциалов раствора и электрода, и переход положительных ионов в раствор будет замедляться.
При какой-то определенной разности потенциалов электрода и раствора наступит равновесие между силой электролитической упругости растворения свинца, с одной стороны, и силами электростатического поля и осмотического давления — с другой.
В результате переход ионов свинца в электролит прекратится.
По завершению процессов восстановления свинца на электродах заряд аккумулятора прекращается. При дальнейшем прохождении электрического тока через электролит начинается процесс электролиза (разложения) воды, при этом аккумулятор «закипает», и выделяющиеся пузырьки образуют смесь водорода и кислорода. Смесь этих газов является взрывоопасной, поэтому следует избегать перезаряда до появления электролизных явлений по разложению воды.
Кроме того, длительный перезаряд приводит к потере электролитом воды (испарению), в результате чего его плотность повышается и для корректировки требуется доливка дистиллированной воды.
При доливке воды необходимо помнить, что вода, попадающая в концентрированную серную кислоту, закипает и сильно разбрызгивает кислотные капли, что при попадании на открытое тело или одежду может привести к ожогам кожи, слизистых оболочек, прожигу одежды и другим неприятным последствиям.
При постоянном напряжении источника зарядного тока по мере увеличения степени заряженности аккумулятора повышается его ЭДС и, следовательно, уменьшается сила зарядного тока. Когда напряжение на клеммах источника тока будет равно ЭДС полностью заряженного аккумулятора плюс ЭДС поляризации, зарядный ток прекратится.
Среднее значение напряжения аккумулятора – 2 В. Поскольку электрооборудование современных автомобилей рассчитано для работы при напряжении в бортовой сети 12 или 24 В, аккумуляторы соединяют в батареи (по 6 или 12 шт.).
Емкость аккумулятора не постоянна, она зависит от силы разрядного тока, температуры электролита и состояния активной поверхности пластин. При увеличении разрядного тока и понижении температуры электролита емкость аккумулятора уменьшается, что объясняется неполным протеканием электрохимических реакций разрядки в этих условиях, вследствие сокращения времени разрядки и повышения вязкости электролита при низких температурах.
- Иметь малое внутренне падение напряжения
- Иметь небольшой саморазряд во время эксплуатации
- Иметь способность выдавать большие токи
- Иметь небольшие габариты и минимальное обслуживание.
Обычно для автомобилей применяются кислотно-свинцовые аккумуляторы , которые имеют напряжение 12 вольт и различаются только по емкости заряда. Автомобильный аккумулятор должен обладать несколькими важными параметрами.
- Иметь малое внутренне падение напряжения
- Иметь небольшой саморазряд во время эксплуатации
- Иметь способность выдавать большие токи
- Иметь небольшие габариты и минимальное обслуживание.
Всем этим параметрам и соответствует кислотно-свинцовый аккумулятор, об устройстве которого поговорим ниже.
Во время разряда частицы активного кислорода из окислов никеля выделяются в электролит и направляются на отрицательные пластины, где окисляют кадмий.
 В широком смысле слова в технике под термином «Аккумулятор» понимается устройство, которое позволяет при одних условиях эксплуатации накапливать определенный вид энергии, а при других — расходовать ее для нужд человека.
В широком смысле слова в технике под термином «Аккумулятор» понимается устройство, которое позволяет при одних условиях эксплуатации накапливать определенный вид энергии, а при других — расходовать ее для нужд человека.
Их применяют там, где необходимо собрать энергию за определенное время, а затем использовать ее для совершения больших трудоемких процессов. Например, гидравлические аккумуляторы, используемые в шлюзах, позволяют поднимать корабли на новый уровень русла реки.
Электрические аккумуляторы работают с электроэнергией по этому же принципу: вначале накапливают (аккумулируют) электричество от внешнего источника заряда, а затем отдают его подключенным потребителям для совершения работы. По своей природе они относятся к химическим источникам тока, способным совершать много раз периодические циклы разряда и заряда.
Во время работы постоянно происходят химические реакции между компонентами электродных пластин с заполняющим их веществом — электролитом.
Принципиальную схему устройства аккумулятора можно представить рисунком упрощенного вида, когда в корпус сосуда вставлены две пластины из разнородных металлов с выводами для обеспечения электрических контактов. Между пластинами залит электролит.
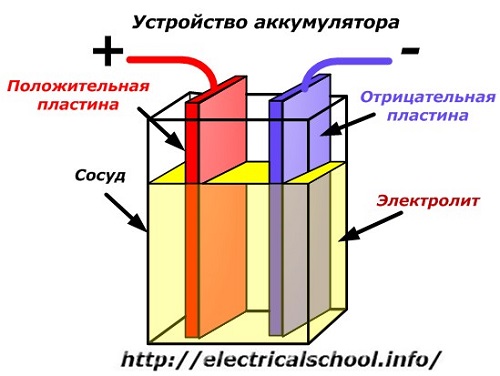
Работа аккумулятора при разряде
Когда к электродам подключена нагрузка, например, лампочка, то создается замкнутая электрическая цепь, через которую протекает ток разряда. Он формируется движением электронов в металлических частях и анионов с катионами в электролите.
Этот процесс условно показан на схеме с никель-кадмиевой конструкцией электродов.
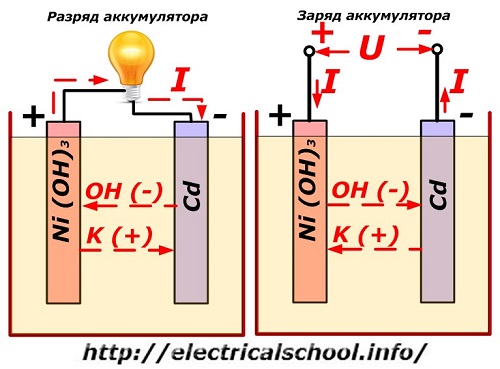
Здесь в качестве материала положительного электрода используют окислы никеля с добавками графита, которые повышают электрическую проводимость. Металлом отрицательного электрода работает губчатый кадмий.
Во время разряда частицы активного кислорода из окислов никеля выделяются в электролит и направляются на отрицательные пластины, где окисляют кадмий.
Работа аккумулятора при заряде
При отключенной нагрузке на клеммы пластин подается постоянное (в определенных ситуациях пульсирующее) напряжение большей величины, чем у заряжаемого аккумулятора с той же полярностью, когда плюсовые и минусовые клеммы источника и потребителя совпадают.
Зарядное устройство всегда обладает большей мощностью, которая «подавляет» оставшуюся в аккумуляторе энергию и создает электрический ток с направлением, противоположным разряду. В результате внутренние химические процессы между электродами и электролитом изменяются. Например, на банке с никель кадмиевыми пластинами положительный электрод обогащается кислородом, а отрицательный — восстанавливается до состояния чистого кадмия.
При разряде и заряде аккумулятора происходит изменение химического состава материала пластин (электродов), а электролита не меняется.
Способы соединения аккумуляторов
Величина тока разряда, которую может выдержать одна банка, зависит от многих факторов, но в первую очередь от конструкции, примененных материалов и их габаритов. Чем значительнее площадь пластин у электродов, тем больший ток они могут выдерживать.
Этот принцип используется для параллельного подключения однотипных банок у аккумуляторов при необходимости увеличения тока на нагрузку. Но для заряда такой конструкции потребуется поднимать мощность источника. Этот способ используется редко для готовых конструкций, ведь сейчас намного проще сразу приобрести необходимый аккумулятор. Но им пользуются производители кислотных АКБ, соединяя различные пластины в единые блоки.
В зависимости от применяемых материалов, между двумя электродными пластинами распространенных в быту аккумуляторов может быть выработано напряжение 1,2/1,5 или 2,0 вольта. (На самом деле этот диапазон значительно шире.) Для многих электрических приборов его явно недостаточно. Поэтому однотипные аккумуляторы подключают последовательно, причем это часто делают в едином корпусе.
Примером подобной конструкции служит широко распространенная автомобильная разработка на основе серной кислоты и свинцовых пластин-электродов.
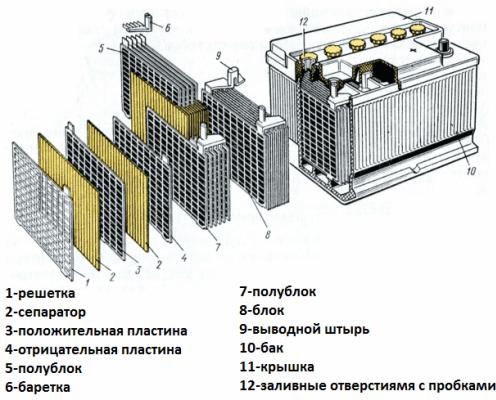
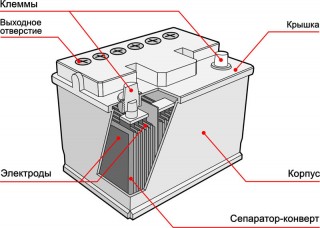
Обычно в народе, особенно среди водителей транспорта, принято называть аккумулятором любое устройство, независимо от количества его составных элементов — банок. Однако, это не совсем правильно. Собранная из нескольких последовательно подключенных банок конструкция является уже батареей, за которой закрепилось сокращенное название «АКБ» . Ее внутреннее устройство показано на рисунке.
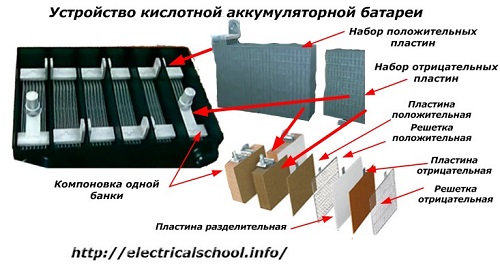
Любая из банок состоит из двух блоков с набором пластин для положительного и отрицательного электродов. Блоки входят друг в друга без металлического контакта с возможностью надежной гальванической связи через электролит.
При этом контактные пластины имеют дополнительную решетку и отдалены между собой разделительной пластиной — сепаратором.
Соединение пластин в блоки увеличивает их рабочую площадь, снижает общее удельное сопротивление всей конструкции, позволяет повышать мощность подключаемой нагрузки.
С внешней стороны корпуса такая АКБ имеет элементы, показанные на рисунке ниже.
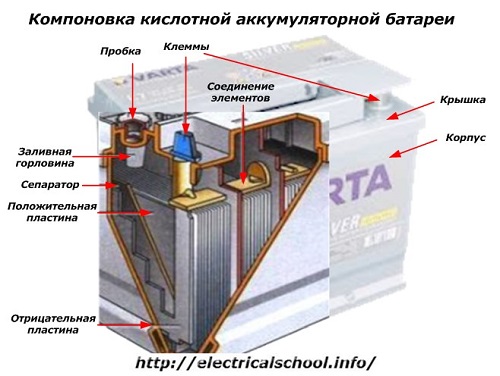
Из него видно, что прочный пластмассовый корпус закрыт герметично крышкой и сверху оборудован двумя клеммами (обычно конусной формы) для подключения к электрической схеме автомобиля. На их выводах выбита маркировка полярности: «+» и «-». Как правило, для блокировки ошибок при подключении диаметр положительной клеммы немного больше, чем у отрицательной.
У обслуживаемых аккумуляторных батарей сверху каждой банки размещена заливная горловина для контроля уровня электролита или доливки дистиллированной воды при эксплуатации. В нее вворачиваются пробка, которая предохраняет внутренние полости банки от попадания загрязнений и одновременно не дает выливаться электролиту при наклонах АКБ.
Поскольку при мощном заряде возможно бурное выделение газов из электролита (а этот процесс возможен при интенсивной езде), то в пробках делаются отверстия для предотвращения повышения давления внутри банки. Через них выходят кислород и водород, а также пары электролита. Подобные ситуации, связанные с чрезмерными токами заряда, желательно избегать.
На этом же рисунке показано соединение элементов между банками и расположение пластин-электродов.
Стартерные автомобильные АКБ (свинцово-кислотные) работают по принципу двойной сульфатации. На них во время разряда/заряда происходит электрохимический процесс, сопровождающийся изменением химического состава активной массы электродов с выделением/поглощением в электролит (серную кислоту) воды.
Этим объясняется повышение удельной плотности электролита при заряде и снижение при разряде батареи. Другими словами, величина плотности позволяет оценивать электрическое состояние АКБ. Для ее замера используют специальный прибор — автомобильный ареометр.
Входящая в состав электролита кислотных батарей дистиллированная вода при отрицательной температуре переходит в твердое состояние — лед. Поэтому, чтобы автомобильные аккумуляторы не замерзали в холодное время, необходимо применять специальные меры, предусмотренные правилами эксплуатации.
Какие существуют типы аккумуляторов
Современное производство для различных целей выпускает более трех десятков разнообразных по составу электродов и электролиту изделий. Только на основе лития работает 12 известных моделей.

В качестве металла электродов могут встретиться:
Рис. Свинцово-кислотная стартерная аккумуляторная батарея:
1, 3 — отрицательные и положительные пластины соответственно; 2 — сепаратор; 4, 6, 8 — перемычки; 5 — предохранительный щиток; 7 — крышка; 9 — пробка; 10 — полюсный вывод (штырь); 11 — Моноблок; 12 — призматические ребра; 13 — блок пластин
Этот процесс можно повторять многократно: при работающем генераторе электрическая энергия накапливается (заряд), а при неработающем запасенная энергия расходуется на питание потребителей (разряд). Простейшие аккумуляторы, состоящие из двух пластин (положительной и отрицательной), объединяют в аккумуляторную батарею, соединяя пластины последовательно друг с другом.
Применяются аккумуляторные батареи, вырабатывающие постоянный ток напряжением 12 В (на карбюраторных машинах) или 24 В (на ТС с дизелем).
Полностью заряженный свинцово-кислотный аккумулятор имеет напряжение 2,0… 2,1 В. Поэтому для получения источника тока напряжением 12 В необходимо последовательно соединить 6 аккумуляторов, а для получения источника напряжением 24 В — 12 аккумуляторов. Такое сравнительно низкое напряжение используется потому, что оно малоопасно для человека в случае появления неисправности в электросистеме ТС.
Емкость аккумуляторной батареи, измеряемая в амперчасах (А-ч), зависит от температуры электролита и силы разрядного тока. Чем ниже температура, тем меньшее количество энергии может отдать батарея. Так, при понижении температуры на 1 °С емкость уменьшается на 1 %. При определенной низкой температуре электролит аккумуляторной батареи может замерзнуть, что повлечет за собой разрушение аккумулятора и выход его из строя.
Под номинальной емкостью батареи С20 понимают ее емкость при 20-часовом разряде и силе разрядного тока 0,05 С20 А. Разряд осуществляется до конечного напряжения на выводных штырях, равного 10,5 В для 12-вольтной батареи.
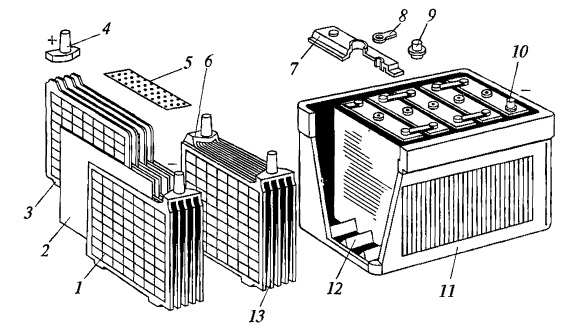
Рис. Свинцово-кислотная стартерная аккумуляторная батарея:
1, 3 — отрицательные и положительные пластины соответственно; 2 — сепаратор; 4, 6, 8 — перемычки; 5 — предохранительный щиток; 7 — крышка; 9 — пробка; 10 — полюсный вывод (штырь); 11 — Моноблок; 12 — призматические ребра; 13 — блок пластин
Сухозаряженные батареи в процессе изготовления на аккумуляторном заводе заряжают полностью, а затем сливают электролит и герметизируют батареи. Перед началом эксплуатации их заливают электролитом плотностью 1,25… 1,27 г/см3.
Температура замерзания электролита зависит от его плотности, а последняя, в свою очередь, от степени разряженности конкретной батареи. Плотность электролита у полностью заряженного аккумулятора при температуре 20 °С составляет 1,22… 1,39 г/см3, а у полностью разряженного — 1,15… 1,16 г/см3.
Электролит представляет собой раствор серной кислоты в воде. Если в 1 л электролита заряженного аккумулятора содержится 500 г чистой серной кислоты и около 800 г воды, то плотность электролита, г/см3, рассчитывается по формуле:
Нормальной плотностью электролита в полностью заряженной аккумуляторной батарее при температуре окружающего воздуха 15°С считается 1,27… 1,29 г/см3. Летом плотность понижают до значений 1,27… 1,24 г/см3, а зимой из-за опасности замерзания электролита повышают до 1,31 г/см3.
Таблица. Взаимосвязь параметров электролита и аккумуляторной батареи
Аккумуляторные батареи, применяемые на ТС, при необходимости соединяют друг с другом, повышая их общую емкость или номинальное напряжение. При параллельном соединении батарей их общая емкость равна сумме емкостей отдельных батарей, а общее напряжение не изменяется. При последовательном соединении общее напряжение равно сумме напряжений отдельных батарей, а общая емкость остается неизменной.
Стандартное устройство аккумуляторной батареи представляет собой контейнер, состоящий из шести секций (или, как их называют, «банок»). Каждая секция – это отдельный источник питания. Она вырабатывает порядка 2 – 2,1 В. Стандартная АКБ рассчитана на 12 В.
Автомобильный аккумулятор выполняет три функции. Основанная функция АКБ – это запуск двигателя. Также, батарея питает бортовые электрические устройства – при неработающем двигателе. Вторая важная функция – возможность аварийного питания, источником которого аккумулятор выступает в случае поломки генератора. Третья функция – это достижение баланса напряжения, которое поступает от генератора. Эта функция характерна для инжекторных двигателей.
Устройство аккумулятора автомобиля существенно не меняется уже много десятилетий. Хотя развитие технологий и появление новых материалов более высокого качества способствует более надежной конструкции и работе АКБ.
Основу работы аккумулятора составляет принцип возникновения разности потенциалов – то есть, напряжения. Оно возникает между пластинами, которые погружены в раствор электролита.
АКБ – устройство, которое, в зависимости от типа и производителя, имеет определенные конструктивно-технологические различия. Но общий принцип – одинаков: все аккумуляторные батареи содержат электроды, разделенные сепараторами, и помещенные в пространство, заполненное электролитом.
Корпус
Корпус аккумулятора состоит из двух частей: основной глубокой емкости и закрывающей крышки. Она может быть оснащена горловинами с пробками или системой, при помощи которой стабилизируется давление внутри батареи, и отводится образующийся газ. Конструкция корпуса зависит от типа АКБ.
Сам корпус изготовлен из материала, к которому предъявляются большие требования прочности и безопасности. Он должен быть устойчив к воздействию агрессивных химических реагентов, переносить колебания температуры и сильную вибрацию. В большинстве современных аккумуляторов корпус сделан из полипропилена.
Внутренние отсеки
Стандартное устройство аккумуляторной батареи представляет собой контейнер, состоящий из шести секций (или, как их называют, «банок»). Каждая секция – это отдельный источник питания. Она вырабатывает порядка 2 – 2,1 В. Стандартная АКБ рассчитана на 12 В.
В каждой из ячеек находится набор (или пакет) из отдельных пластин с чередующейся полярностью. То есть, одна пластина положительная, другая отрицательная. Причем, пластины отделены друг от друга. Пластины сделаны из свинца и имеют решетчатую структуру в виде прямоугольных сот. Это облегчает нанесение них активной массы – основного рабочего реагента.
Пластины
Для увеличения прочности пластин в них добавляют сурьму. У этой технологии есть и свои недостатки: присутствие сурьмы способствует выкипанию воды из электролита. Это – основная причина, по которой практически во все типы АКБ необходимо доливать воду. Но технологии не стоят на месте. Устройство автомобильных аккумуляторов совершенствуется. Количество сурьмы в свинцовых пластинах значительно уменьшилось, благодаря чему появились малообслуживаемые и гибридные аккумуляторы.
На положительный электрод наносится двуокись свинца, на отрицательный – губчатый свинец. Внутрь заливается электролит, который является водным раствором серной кислоты.
Каждая чередующаяся пластина является электродом, имеющим противоположную полярность. Таким образом, с целью предотвращения замыкания, между каждой парой пластин располагается сепаратор. Он изготовлен из пористого пластика и не создает препятствий для циркуляции электролита внутри ячейки.
Пластин с отрицательной полярностью больше на 1 единицу, так как каждая пластина с положительным зарядом помещена между двумя отрицательными (минусовыми).
Пакет с пластинами надежно фиксируется, чтобы предотвратить смещение и деформацию. Фиксация осуществляется при помощи специального бандажа. Токовыводы пластин (плюсовые и минусовые) объединены в пары. Концентрация энергии происходит при помощи токосборников – на выводные борны аккумулятора. К ним токоприемные клеммы.
Устройство АКБ обеспечивает максимальную надежность. Современные аккумуляторы – это качественные устройства, выступающие источниками питания даже для самых мощных автомобилей.
Виды современных аккумуляторов
Главное различие необслуживаемых АКБ от классических – в более низких разрядных и зарядных токах. Причина – в конструкции необслуживаемых батарей. При больших токах классическая АКБ активно выделяет газ и «закипает». У необслуживаемых и герметизированных батарей этого нет.
Наилучшие условия их работы – это равномерная отдача электроэнергии на всем этапе разряда, то есть применение на электротранспорте, инвалидных колясках, гольф-карах, складской и другой технике с использованием циклического режима работы. Но это не исключает возможность применения их в системах альтернативной энергетики, а также системах телекоммуникации и связи.
Факторы срока службы батарей и способы его продления
Общеизвестно, что одним из определяющих факторов срока службы обычной свинцово-кислотной батареи является коррозия положительного электрода с последующим увеличением его объема. По мере того, как положительный электрод подвергается коррозии, возникающее расширение объема вызывает механические нагрузки на электрод, приводящие к его растрескиванию и разлому. Далее, на развившихся стадиях коррозии, может произойти внутреннее замыкание решетки и разрыв корпуса батареи.
Одним из способов потенциального продления срока службы в таких условиях является увеличение сопротивляемости коррозии электродов. Углеродное покрытие электродов снижает скорость коррозии электродов путем ограничения контакта между раствором электролита и металлом электрода. При этом электропроводность углерода позволяет осуществлять электронный обмен во время процессов разряда и заряда аккумуляторной батареи.
Таким образом, добавление углерода с состав электродов позволило добиться следующих результатов при эксплуатации свинцово-углеродных аккумуляторных батарей:
- Сниженная сульфатация при частичном заряде;
- Улучшенные разрядные характеристики;
- Улучшенные показатели циклического использования;
- Увеличенный срок службы в буферном режиме;
- Увеличенный срок хранения без подзаряда;
- Сокращение сроков ускоренного заряда;
- Уменьшение тепловыделения при заряде.
Свинцово-углеродные аккумуляторы идут на замену обычным свинцово-кислотным аккумуляторным батареям с решающим преимуществом в возможности быстрого заряда без повреждений, работы в циклическом режиме с разрядами от 30% до 70% без риска сульфатации, а также отсутствии необходимости принудительного охлаждения.
Но есть и недостатки: быстрое падение напряжения при разряде, особенно при высоких нагрузках. Поэтому применение их как стартерных батарей не целесообразно. Также из-за электрохимических реакций наблюдается увеличение скорости выделения водорода, хотя сегодня в науке процесс выделения водорода на углероде пока не так хорошо изучен.
Наилучшие условия их работы – это равномерная отдача электроэнергии на всем этапе разряда, то есть применение на электротранспорте, инвалидных колясках, гольф-карах, складской и другой технике с использованием циклического режима работы. Но это не исключает возможность применения их в системах альтернативной энергетики, а также системах телекоммуникации и связи.
В перспективе планируется перейти на полностью углеродные электроды, что в корне изменит и название батареи. Она будет полностью углеродной. На самом деле идея полностью углеродной батареи не является новой и разрабатывается в Японии с 70-х годов прошлого века. Около 6-7 лет назад ученые университета Куйсю (Kyushu University) начали работу по нанотехнологиям и улучшению углеродного материала, что позволило значительно увеличить производственную мощность этих батарей.
Отправить заявку
Оставьте свои контактные данные, и наши специалисты свяжутся с вами, для консультации или оформления заказа
http://www.autoezda.com/component/tags/tag/%D0%BF%D1%80%D0%B8%D0%BD%D1%86%D0%B8%D0%BF-%D1%80%D0%B0%D0%B1%D0%BE%D1%82%D1%8B-%D0%B0%D0%BA%D0%BA%D1%83%D0%BC%D1%83%D0%BB%D1%8F%D1%82%D0%BE%D1%80%D0%BD%D0%BE%D0%B9-%D0%B1%D0%B0%D1%82%D0%B0%D1%80%D0%B5%D0%B8-%D0%B0%D0%BA%D0%B1.html
http://pue8.ru/elektricheskie-seti/805-kak-rabotaet-akkumulyator-i-iz-chego-on-sostoit.html
http://electrik.info/device/1297-ustroystvo-i-princip-raboty-akkumulyatora.html
http://kwatt.com.ua/chto-takoe-akkumulyator-osnovnye-ponyatiya-printsip-raboty-i-nemnogo-istorii/
http://k-a-t.ru/mdk.01.01_elektro/2-ab/index.shtml
http://autoustroistvo.ru/elektrooborudovanie/akb/
http://electricalschool.info/spravochnik/eltehustr/1521-kak-ustroen-i-rabotaet-akkumuljator.html
http://ustroistvo-avtomobilya.ru/akkumulyator-generator-starter/akb/akkumulyatornaya-batareya/
http://www.1ak-m.ru/art/ustroistvo-avtomobilnogo-akkumuliatora
http://wybor-battery.com/stati/karbonovye-uglerodnye-akkumulyatornye-batarei/